유나이티드ㆍ바이오켐ㆍ중외, 피타바스타틴+페노피브릭산 제제 허가
마리타이드, 2상 임상서 당뇨 없는 비만 환자 체중 최대 20% 감소 확인
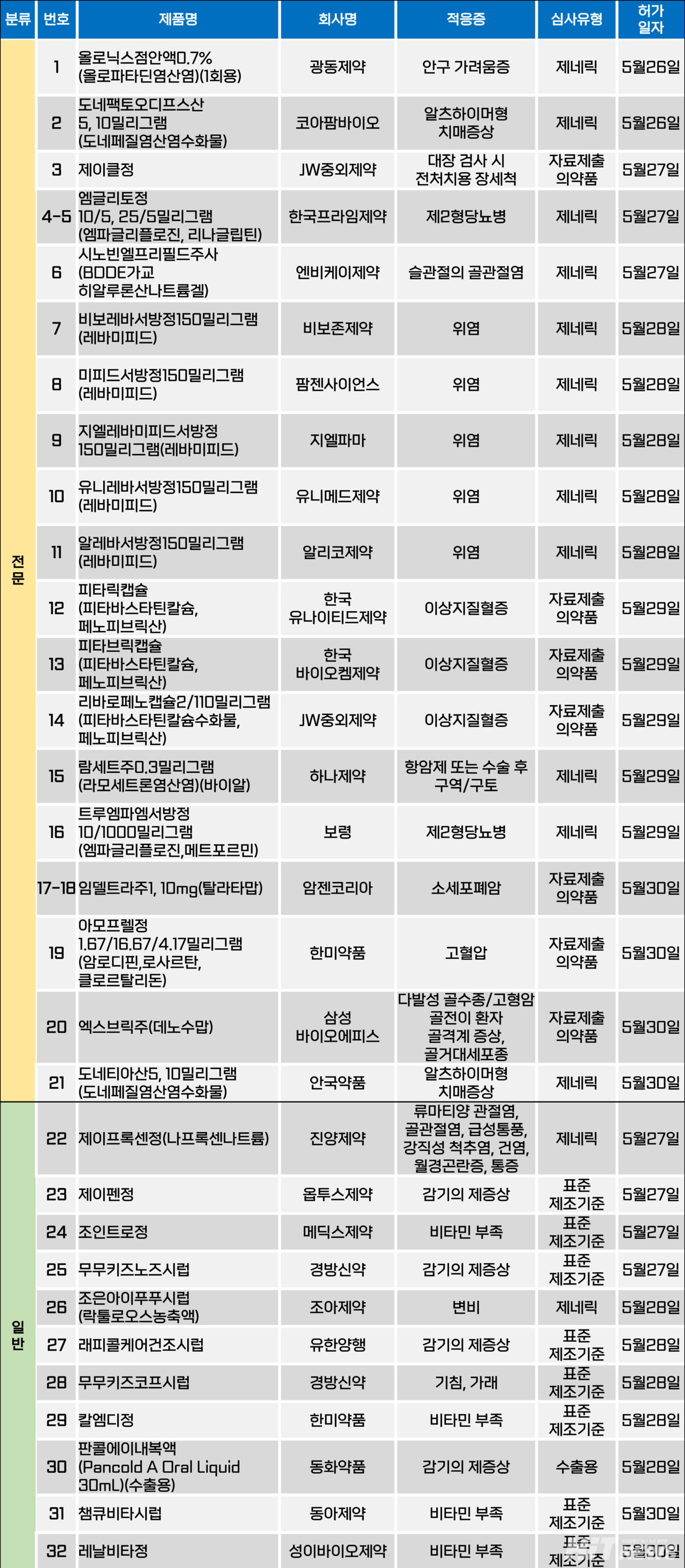
지난주(5월 26~5월 30일) 총 32개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품 21개, 일반의약품 1개 품목이다. 이들은 안구 가려움증, 알츠하이머병 치매증상, 제2형당뇨병, 위염, 이상지질혈증, 고혈압, 소세포폐암, 골거대세포종 등 적응증으로 허가됐다.
고지혈증 치료제 '피타바스타틴(오리지널 리바로)'과 '페노피브릭산' 성분 복합제 허가가 계속되고 있다.
지난달 29일 한국유나이티드제약을 포함한 3개 제약사가 피타바스타틴+페노피브릭산 복합제의 품목허가를 획득했다. 세부적으로 △피타릭(한국유나이티드제약) △피타브릭(한국바이오켐제약) △리바로페노(JW중외제약) 등이 허가됐다.
기존 제품들은 활성형 물질인 페노피브릭산 대신 전구 물질인 페노피브레이트 과립을 포함하고 있었다. 이 성분은 체내 HDL(고밀도) 콜레스테롤의 양은 늘리고, 중성지방 수치를 낮추는 효과를 가져 고지혈증 치료제로 사용되고 있다.
이번에 허가된 3개 품목은 모두 페노피브릭산을 주성분으로 하고 있다. 기존 허가된 동일 성분 및 제형 품목들과 피타바스타틴의 용량은 2㎎으로 같지만, 페노피브릭산의 용량은 절반 수준인 110㎎으로 낮췄다.
피타바스타틴은 JW중외제약이 보유하고 있는 고콜레스테롤혈증의 치료제 '리바로'의 주성분이다. 회사는 이 제제의 판권을 2005년 일본 '코와' 사와 '닛산 화학'으로부터 획득했으며, 이후 2021년 에제티미브 성분과의 복합제인 '리바로젯'을 허가받았다.
과거 2019년 4월 △한림제약 △삼진제약 △지엘파마 △한국프라임제약 △대원제약 △안국약품 △동광제약 △동국제약 등 8개 회사가 공동 생동을 통해 제네릭 품목을 허가 받았고, 현재 총 19개 회사의 품목이 허가돼 있다.
각 품목은 크게 캡슐과 정제 제형으로 존재한다. 기존 캡슐 제형을 정제형태로 개량한 품목은 △피타로우에프(종근당) △제피노(제뉴파마) △바로페노(대웅제약) △피타스론(대우제약)이 있다.
오는 8월 리바로젯의 특허 만료가 예상됨에 따라, 많은 회사들이 출시 시기를 고려해 품목허가 획득에 박차를 가하고 있는 것으로 보인다.
시장조사기관 유비스트에 따르면, 작년 피타바스타틴+페노피브레이트 복합제 시장의 원외처방액 규모는 약 490억7890만원이이다. 이 중 안국약품의 '페바로 에프'가 약 119억6484만원의 처방액으로 선두를 기록하고 있다.

임상시험계획은 총 17건이 승인됐다. 세부적으로 △1상 1건 △2상 1건 △2/3상 1건 △3상 7건 △생물학적 동등성 4건 △연구자 임상 3건 등이다. 이 임상시험들은 비증식 당뇨망막병증, 급성 허혈성 뇌졸중, 비만, 미간주름, IgA 신장병증 등 질환과 자궁내막암, 삼중음성유방암 등 암종을 대상으로 승인됐다.
암젠이 개발중인 비만 치료제 '마리타이드(개발코드명 AMG133, 성분 마리드바트 카프라글루타이드)'의 3상 임상시험이 국내에서 진행된다. 임상시험수탁기관(CRO) 한국아이큐비아는 지난달 26일 2건의 3상 임성시험계획을 승인받았다.
마리타이드는 암젠이 비만 또는 제2형당뇨병 치료제로 개발 중인 신약 물질로, 글루카곤 유사 펩타이드1(GLP-1) 수용체 작용제이자 포도당 의존성 인슐린 분비 촉진 폴리펩타이드 수용체 길항제로 작용하는 이중특이항체다. 월 1회 수준의 투여 간격(혹은 그보다 짧은 간격)을 가진 피하 주사 제형 단일 용량 제품으로 개발되고 있다.
이번 임상은 비만이거나 과체중이면서, 제2형 당뇨병이 없는(연구명 MARITIME-1) 또는 제2형 당뇨병이 있는(연구명 MARITIME-2) 성인 참여자에서 AMG133의 유효성, 안전성 및 내약성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약 대조 3상 연구다.
MARITIME-1 연구는 국내 환자 165명(글로벌 3501명)의 참여를 목표로 △연세대 의대 세브란스병원 △가톨릭대 여의도성모병원 등 19개 의료기관에서, MARITIME-2 연구는 국내 환자 63명(글로벌 999명)의 참여를 목표로 12개 의료기관에서 진행된다. 두 연구 모두 2027년 8월 완료를 목표로 한다.
연구진은 두 연구 모두 AMG133 투여 후 '제72주 시점 체중의 베이스라인 대비 백분율 변화'를 1차 유효성평가변수로 설정했다. 이 외에 동일 시점의 허리 둘레(cm)의 베이스라인 대비 변화, 5~20% 이상 체중 감소 달성율 등이 주요 2차 유효성평가변수로 설정됐다.
한편, 암젠은 작년 제2형 당뇨병이 없는 비만 또는 과체중 환자를 대상으로 한 글로벌 2상 연구 결과를 발표한 바 있다. 이 연구에서AMG133 투여군은 52주차에 최대 약 20%의 체중 감소 효과를 확인했고, 그 이후에도 체중 감량 정체 없이 추가 감량 가능성이 있음을 보였다.
AMG133의 가장 흔한 이상반응은 메스꺼움, 구토, 변비를 포함한 위장관 증상이었으며, 주로 첫 번째 투여 시 나타났다. 점차 용량을 증량할수록 이상반응의 발생률은 감소 경향을 보였다. 용량 증량군에서 이상반응으로 인한 임상시험 중단률은 약 11%로 나타났다.

