휴온스ㆍ아주약품, 엠파글리플로진 성분 25㎎로 높인 2제 복합제 허가
MK-2870, 삼중음성 및 HR 약양성/HER2 음성 유방암 대상 3상
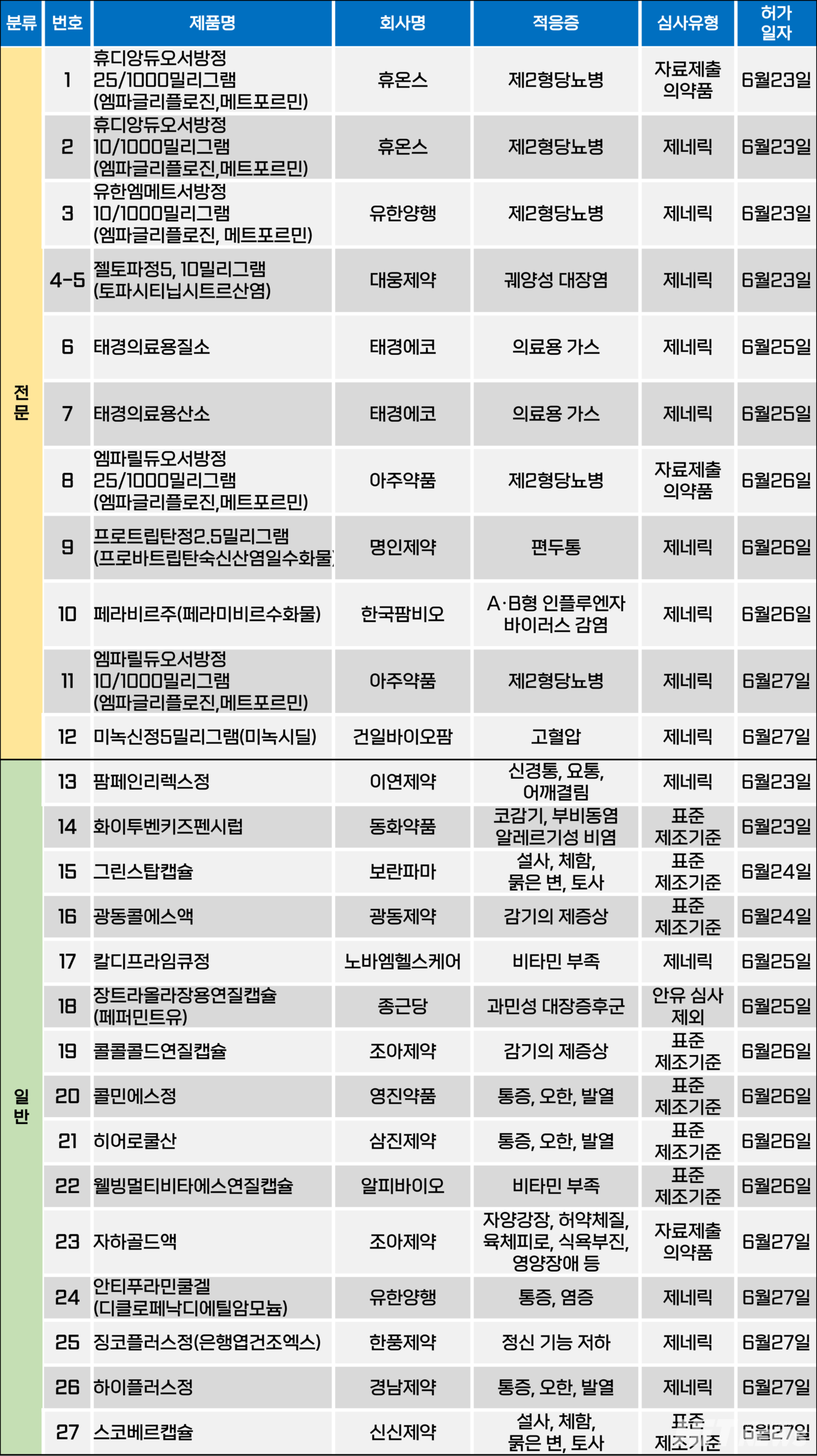
제2형당뇨병 치료제로 사용되는 엠파글리플로진(오리지널 자디앙) 성분 25㎎을 함유한 메트포르민 2제 복합제의 허가가 이어지고 있다.
휴온스와 아주약품은 지난 23일과 26일 엠파글리플로진 25㎎과 메트포르민 1000㎎ 함유 2제 복합제 '휴디앙듀오서방정'과 '엠파릴듀오서방정'을 허가받았다.
기존 엠파글리플로진 성분을 5, 10, 12.5㎎을 포함한 품목은 다수 존재했지만, 25㎎ 용량의 품목은 △한국프라임제약 '엠글리듀오서방정' △대원제약 '엠파메트서방정' △동구바이오제약 '엠파앙듀오서방정' △에이프로젠바이오로직스 '엠파콤비서방정' △동광제약 '엠플로엠서방정' △하나제약 '자디스듀오서방정' △보령 '트루엠파엠서방정' 등 8개에 불과했다.
한편, 오는 10월 23일 물질 특허 만료를 앞두고 있는 엠파글리플로진 성분 복합제의 허가가 지속되고 있다. 6월 30일 기준 자디앙, 자디앙듀오(성분 엠파글리플로진+메트포르민염산염), 에스글리토(성분 엠파글리플로진+리나글립틴) 등 오리지널 제품군을 제외한 엠파글리플로진 성분 제제(단일제+복합제)는 총 333개 품목이다.
이 외에도 엠파글리플로진과 시타글립틴(오리지널 포시가) 등 오리지널 사가 보유하지 않은 새로운 조합의 SGLT-2 억제제+DPP-4 억제제 복합제도 등장하고 있다.
현재 국내에서는 종근당과 대원제약이 이 시장에 먼저 2제 및 3제(+메트포르민) 복합제를 허가 받은 상태다. 종근당은 2제 복합제 '엠파맥스에스정' 및 3제 복합제 '엠시폴민서방정'을, 대원제약은 각 '엠파시타정' 및 '엠파시타엠서방정'을 보유하고 있다.
오는 10월까지 이런 엠파글리플로진 성분 복합제 허가 움직임은 이어질 것으로 전망된다. 아직 특허 분쟁이 해결되지 않은 에스글리토를 제외한 오리지널 제품들과 제네릭 간 본격적인 경쟁은 내년 상반기가 될 것으로 전망된다.
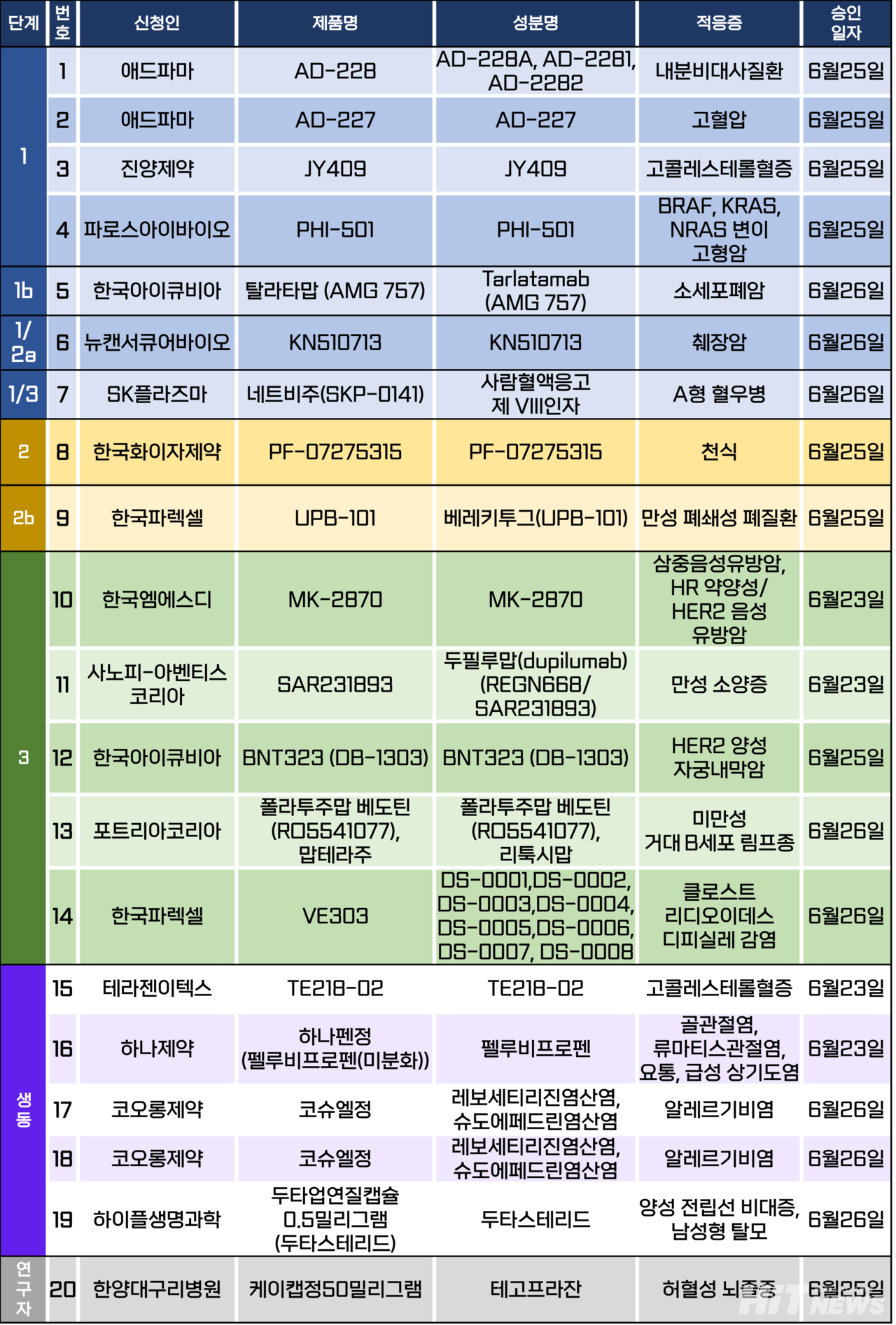
임상시험계획은 총 20건이 승인됐다. 세부적으로 △1상 4건 △1b상 1건 △1/2a상 1건 △1/3상 1건 △2상 1건 △2b상 1건 △3상 5건 △생물학적 동등성 5건 △연구자 임상 1건 등이다. 이 임상시험들은 고혈압, 천식, 고콜레스테롤혈증, A형 혈우병, 만성 폐쇄성 폐질환, 만성 소양증 등 질환과 소세포폐암, 췌장암, 자궁내막암, 유방암, 미만성 거대 B세포 림프종 등 암종을 대상으로 승인됐다.
미국 머크(MSD)가 개발 중인 TROP-2 타깃 항체약물접합체 'MK-2870(성분 사키투주맙 티루모테칸)'의 삼중음성유방암 및 호르몬 수용체(HR) 약양성/HER2 음성 유방암 환자를 대상으로 한 국내 3상 임상시험이 개시된다.
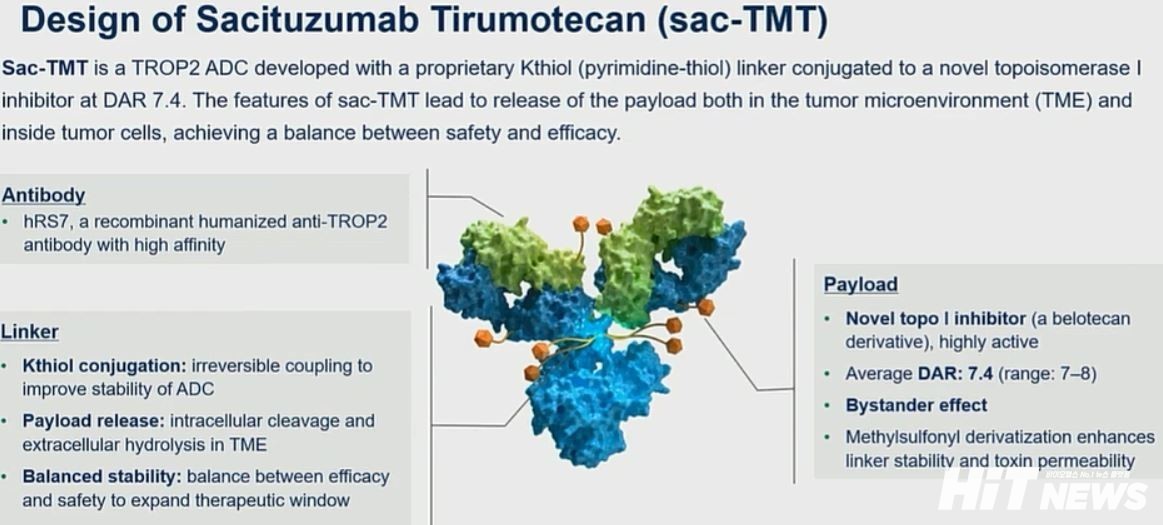
MK-2870은 MSD가 중국 케룬 바이오텍으로부터 도입해온 ADC로, 삼중음성유방암 환자들의 80% 이상에서 과발현이 관찰되는 TROP-2(Tumor-associated calcium signal transducer 2)를 타깃한다. TROP-2는 성장, 변형, 재생 및 증식과 관련된 것으로 알려져 있는 바이오마커다.
한국MSD는 지난 26일 ①고위험, 조기 병기 삼중음성유방암이나 ②HR 약양성/HER2 음성 유방암에 대한 신보조 요법으로서 키트루다(성분 펨브롤리주맙)와의 병합요법으로 투여되는 환경에서 MK-2870DP 이은 카보플라틴+파클리탁셀을 투여하는 요법과 항암화학요법군과 안전성과 유효성을 비교 평가하기 위한 무작위배정, 라벨 공개 3상 임상시험계획을 승인받았다.
이번 연구는 오는 2034년 12월까지 △연세대 의대 세브란스병원 △칠곡경북대병원 △서울대병원 △삼성서울병원 △분당서울대병원 △가톨릭대 서울성모병원 △서울아산병원 등 의료기관에서 진행될 예정이다.
연구진은 이번 연구의 일차유효성평가변수를 병리학적 완전관해(pCR)과 무사건생존율(EFS)로 설정했다. pCR은 신보조 전신 요법 완료 후 완전 절제된 유방 표본과 검체화된 모든 구역 림프절에 대한 헤마톡실린 및 에오신 평가에서 잔류하는 침습성 암이 없는 경우를 말하며, EFS는 무작위배정 시점부터 수술을 막는 질병 진행이나 국소 또는 원격 재발, 원인을 불문한 사망으로 이뤄진 사건들 중 어느 것이든 처음 나타나는 시점까지의 시간을 말한다.
한편, MSD는 MK-2870을 △위암 △유방암 △비소세포폐암 △자궁내막암 등 암종에 사용하기 위한 임상시험에 집중하고 있다. 국내에서 진행중인 3상 임상을 기준으로 현재 그 수는 14건에 달한다. 대부분 키트루다와의 병용요법으로 설계된 점에서, 최근 트렌드로 꼽히는 면역항암제와 ADC 간의 시너지를 위함으로 사료된다.
삼중음성유방암과 키트루다 간 병용요법에 대한 3상 임상시험은 이번이 처음이 아니다. 작년 4월 29일 한국MSD는 신보조 요법을 받았으며, 수술 시 pCR을 달성하지 못했던 환자를 대상으로 MK-2870+키트루다 병용요법을 카페시타빈+키트루다 병용요법과 비교하기 위한 3상 임상시험계획을 승인받은 바 있다.
이 외에 가장 빠른 진행을 보이고 있는 3상은 자궁내막암을 대상으로 한 'MK-2870-005/ENGOT-en23/GOG-3095' 연구로, MK-2870 단독요법과 의사가 선택한 치료와의 비교 임상이다. 임상시험계획에 따르면, 해당 임상은 2028년 1월 내로 완료될 전망이다.

