KEYNOTE-811 임상 3상 연구, 38.5개월 데이터 공개
전체 환자군 질병 진행·사망 위험 27% 감소
PD-L1(CPS≥1) 환자군에서도 동일한 경향 보여

[마드리드(스페인)=황재선 기자] 미국 머크(MSD)가 개발한 면역항암제 키트루다(성분 펨브롤리주맙)의 'HER2 양성(+) 진행성 위암 또는 위식도 접합부 선암' 환자를 대상으로 한 KEYNOTE-811 임상 3상 연구 결과, '키트루다+트라스투주맙(제품명 허셉틴)+플루오로피리미딘 및 백금 기반 항암화학요법' 병용 1차 치료가 질병 및 사망 위험을 대조군(트라스투주맙+항암화학요법) 대비 28% 감소시킨 것으로 나타났다.
HER2 양성 진행성 위암 환자를 대상으로 트라스투주맙+항암화학요법이 2010년 1차 치료법으로 허가된 이후 유의미한 PFS(무진행 생존기간) 및 OS(생존기간) 개선을 보인 연구는 KEYNOTE-811이 처음이라는 평가가 이어지고 있다.

지난 20일(현지 시각) 스페인 마드리드에서 개최된 유럽종양학회(ESMO)에서는 이 같은 내용을 담은 KEYNOTE-811 연구 결과가 발표했다. 연구진은 주요 1차 유효성 평가 변수로 PFS와 OS을 설정했다.
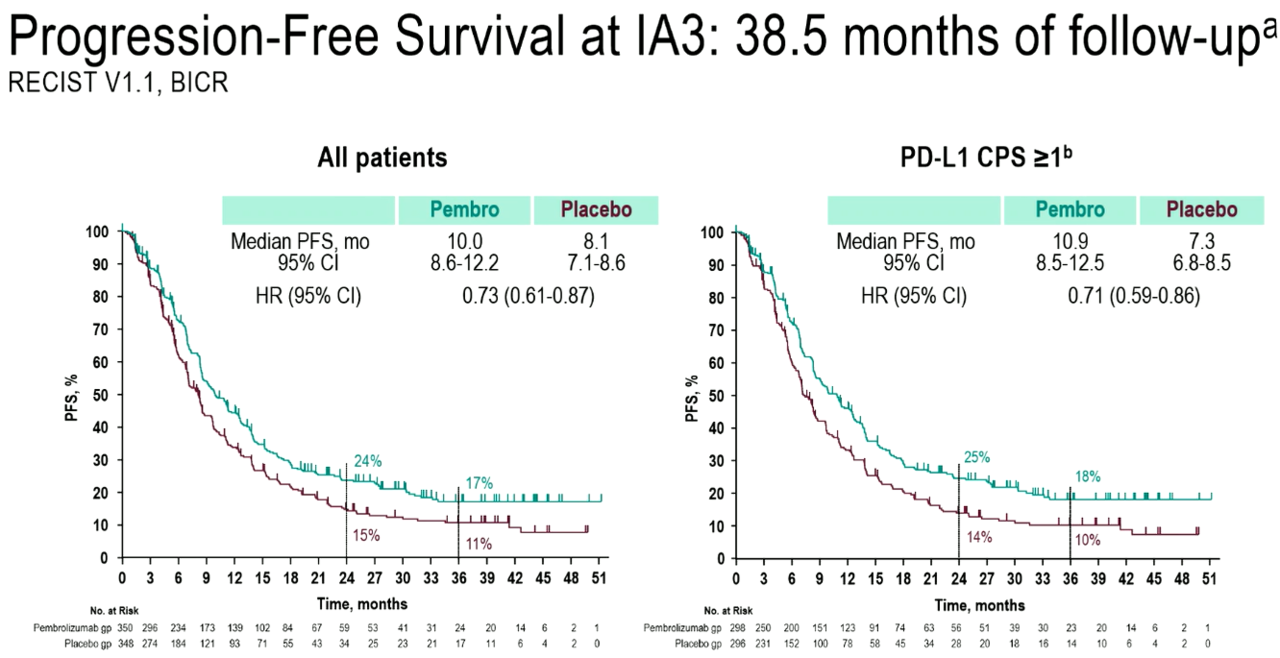
발표 연자를 맡은 메모리얼 슬로안 케터링 암센터의 위장관 종양내과 수석 주치의 옐레나 얀지안(Yelena Y. Janjigian) 박사에 따르면, 연구진은 중앙 추적 관찰 기간 38.5개월 후 전체 환자군(ITT군)에서 △키트루다 병용 요법군은 PFS 10.0개월(95% CI : 8.6-12.2) △대조군은 8.1개월(95% CI : 7.1-8.6)로, 질병 진행 또는 사망 위험을 27%(HR=0.73, 95% CI : 0.61-0.87) 감소시킨 것으로 나타났다.
또 PD-L1(CPS≥1) 발현 환자군에서도 △병용 요법군은 PFS 10.9개월(95% CI : 8.5-12.5) △대조군 7.3개월(95% CI : 6.8-8.5)로, 질병 진행 또는 사망 위험을 30% 감소시켰다(HR=0.70, 95% CI : 0.59-0.86). 이 임상에서 PD-L1(CPS ≥1) 발현 환자는 전체 환자의 80% 이상에 해당했다.
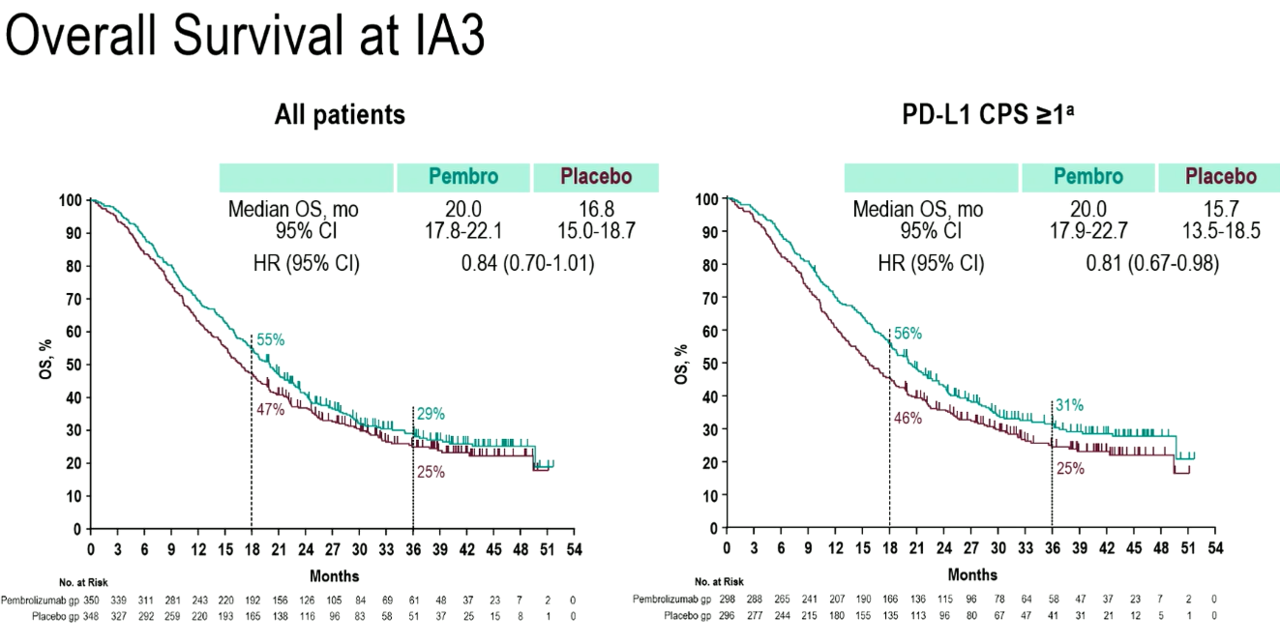
옐레나 얀지안 박사는 "같은 시점 OS 중앙값 데이터를 살펴보면, ITT군에서 △키트루다 병용 요법군 20.0개월(95% CI : 17.8-22.1) △대조군 16.8개월(95% CI : 15.0-18.7)로 사망에 대한 위험을 16% 감소시켰으며(HR=0.84, 95% CI : 0.70-1.01), PD-L1(CPS ≥1) 발현 환자군에서 △병용군 PFS 20.0개월(95% CI : 17.9-22.7) △대조군 15.7개월(95% CI : 13.5-18.7)로 사망에 대한 위험을 19%(HR=0.81, 95% CI : 0.67-0.98) 감소시킨 것으로 나타났다"고 설명했다. 이어 "다만 아직 OS가 데이터가 미성숙한 상태로 아직 통계적 유의성에 도달하지 못한 상태"라며 "이번 연구에 대해 향후 계획된 OS 분석과 관련한 후속 조치가 진행 중"이라고 덧붙였다.

지난 21일 행사장을 찾은 류민희 서울아산병원 종양내과 교수는 히트바카라사이트에 "ITT군에서 3.2개월, PD-L1(CPS>-1) 발현군에서도 4.3개월의 OS 중앙값의 절대적 차이가 발생했고, ITT군에서 사망 위험을 30% 낮췄다"면서 "물론 아직 OS 중앙값 데이터가 충분히 성숙하지 않아 추후 한 번 더 추적 분석이 필요하겠지만, 항암 영역에서 이 정도 차이는 상당한 의미가 있는 수치"라고 평가했다.
류 교수는 이어 "최근 유럽 HER2 양성 진행성 위암 또는 위식도접합부 선암 환자 치료 가이드라인에 키트루다 병용 요법이 포함됐는데, 이는 실제 임상 현장에서도 활용될 수 있는 영역에 들어왔다고 해석할 수 있다"며 "우리나라는 아직 허가 및 급여 절차가 남아있는 만큼 좀 더 지켜봐야 겠지만, 과거 트라스투주맙+항암화학요법이 2010년 허가된 이후 약 십여 년만에 HER2 양성 위암 환자의 PFS, OS 등을 개선한 연구 결과가 나온 만큼 추후 국내 환자에게도 빨리 활용할 수 있기를 바란다"고 전했다.
한편 키트루다는 KEYNOTE-811 연구 결과를 바탕으로 HER2 양성 진행성 위암 또는 위식도접합부 선암 환자의 1차 치료에서 트라스투주맙, 플루오로피리미딘 및 백금 기반 항암화학요법 병용 치료로 지난 8월 유럽연합(EU)에서 허가를 받았고, 이보다 앞서 2021년 5월에는 미국 식품의약국(FDA)에서 신속 허가를 받아 사용되고 있는 중이다. 회사는 현재 FDA와 이 적응증의 정식 허가를 위해 논의 중인 것으로 알려졌으며, 식품의약품안전처에도 허가를 신청한 상태다. 빠르면 내년 상반기 중 국내 허가를 목표로 하고 있다.
이번 연구 결과 발표에 대해 MSD연구소 글로벌임상개발부 후기 항암제 부문 총괄 마조리 그린(Marjorie Green) 수석 부사장은 "ESMO에서 공개된 KEYNOTE-811 연구의 PFS 데이터는 종합적인 증거를 기반으로 도출된 결과"라며 "이번 연구 결과는 PD-L1(CPS ≥1) 발현 진행성 HER2 양성 위암 또는 위식도 접합부 선암 환자를 위한 치료옵션으로써 키트루다+트라스트주맙+항암화학요법 병용 요법의 중요성을 뒷받침하고 있다. 앞으로도 치료가 어려운 위장관암의 효과적인 치료법을 계속 연구하겠다"고 말했다.
관련2025 바카라사이트
- 키트루다, 유럽서 HER2+진행성 위암·위식도 접합부 선암에 허가
- [영상] ESMO 어떤 분위기인지 궁금했다고요? 눌러보시면 됩니다
- 한국MSD "키트루다 여성암 보험급여 확대 필요" 공론화
- 본부장 지시로 억지로 촬영·편집한 '마드리드 to 바르셀로나'
- "키트루다, HER2 양성위암 1차 치료제로... 13년만의 새 옵션"
- HER2 양성 위암 1차 치료로 확대 '키트루다', 안주 없이 계속 '직진'
- '키트루다+바카라 사이트 먹튀' 병용, HER2 음성 위암 1차
- 키트루다+허셉틴+화학요법, PD-L1·HER2양성 위암 치료표준 바꿔
- Keytruda Combo Therapy Redefines PD-L1/HER2+ Gastric Cancer Treatment
