히터뷰ㅣ 남기엽 파로스아이바카라사이트 비타임 사장
"조건부 승인 목표로 글로벌 2상 추진...AI 플랫폼 '케미버스'로 차별화
"기존 FLT3 저해제 사용 환자에서도 치료 효과를 보였다는 점에서 PHI-101의 임상 1상 결과는 산업적으로 매우 의미가 크다. 단순히 안전성을 확인한 것이 아니라, 치료가 어려운 환자에서 종합완전관해(CRc, composite complete remission) 효능을 유도했기 때문입니다."
남기엽 파로스아이바이오 사장은 최근 히트바카라사이트와 인터뷰에서 이같이 말하며, FLT3 저해제 계열 치료제의 한계를 넘어서는 새로운 대안을 제시하고 있다고 강조했다.

"PHI-101, FLT3 돌연변이 AML 환자서 조기상용화 추진"
PHI-101은 파로스아이바카라사이트 비타임가 개발 중인 FLT3 저해제 계열 항암제로, 급성골수성백혈병(AML) 환자 중 FLT3 돌연변이를 가진 재발성 환자를 주요 적응증으로 한다. 전체 AML 환자 중 약 35%에서 FLT3 변이가 관찰되며, 이들은 예후가 나쁜 고위험군으로 분류된다.
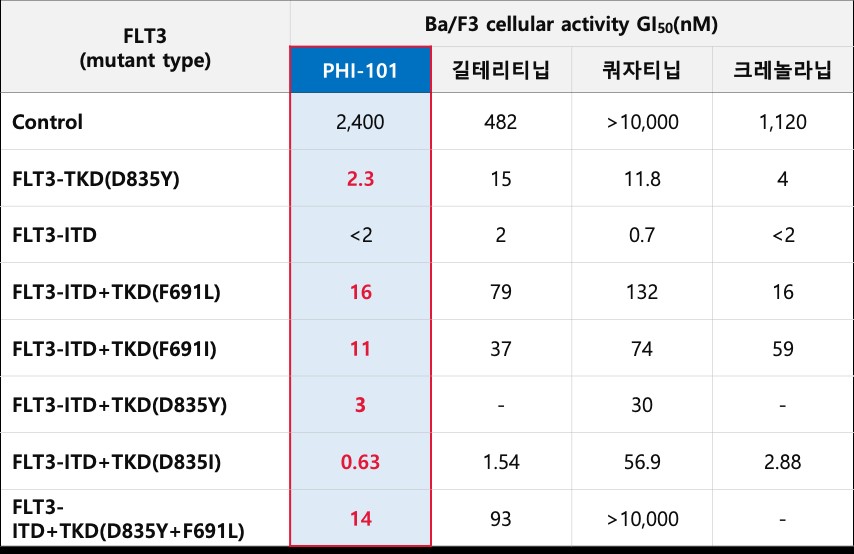
PHI-101은 특히 기존 치료제인 조스파타(길터리티닙), 반플리타(퀴자티닙) 등 FLT3 억제제 이후 치료옵션이 마땅치 않은 환자에서 후속 약물로 설계됐다. "현재 임상 1상 확장 코호트에서 평가 가능 환자 중 종합완전관해률(CRc) 50%, 객관적반응률(ORR, overall response rate)률 67%를 기록했다. FLT3 억제제를 이미 사용한 환자가 다수 포함된 코호트라는 점에서 의미가 남다르다"고 그는 설명했다.
FLT3-TKD 변이 중 D835Y, F691L 등은 조스파타 또는 반플리타에서도 낮은 반응률과 내성 문제가 보고된 바 있다. 남 사장은 "동일한 조건에서 PHI-101은 조스파타나 반플리타 대비 적어도 3배, 최대 10배까지 높은 세포 성장 억제 효과를 나타냈다"고 말했다. "특히 D835Y와 F691L을 포함한 돌연변이에서 강력한 억제 활성을 보인 것은, PHI-101이 후속 치료제로 자리잡을 수 있다는 임상적 근거"라고 덧붙였다.
28일 주기로 PHI-101을 투여한 임상 1상 시험에서는 FLT3 변이 AML 환자에게서 악성 골수세포가 평균 87%, 최대 98%까지 줄어드는 효과가 나타났다.
그는 "PHI-101은 이미 FDA로부터 희귀의약품으로 지정받은 바 있어, 조건부 승인을 위한 빠른 진입 전략이 가능하다. 글로벌 임상 2상에서도 선행 FLT3 억제제 사용 후 재발 환자를 대상으로 완전반응률을 주요 평가 지표로 삼아 경쟁 약물 대비 우월성을 입증할 계획"이라고 말했다.
기술이전 협상도 가속화되고 있다. 남 사장은 "글로벌 바이오텍은 임상 1상에서 확보한 효능 데이터에 주목하고 있고, 글로벌 제약사는 향후 병용전략 및 적응증 확장 가능성에 관심을 보이고 있다"며 "조건부 승인을 받은 뒤 조기 상용화 및 기술이전이 가능한 구조를 만들고 있다"고 밝혔다. 그러면서 "글로벌은 라이선스 아웃, 한국은 별도 파트너를 고려하고 있다"라고 덧붙였다.
"임상에서 검증되는 AI 신약 많지 않아...기술이전 철저히 고려"
PHI-101의 후보물질을 선정하는데 심장 독성 예측에서 파로스아이바카라사이트 비타임의 AI 신약개발 플랫폼 '케미버스(Chemiverse)'가 전면적으로 적용됐다. 그에 따르면 케미버스는 단순한 약물 설계 도구가 아니라, 실제 높은 임상 성공확률로 이어질 수 있는 '전 주기 약물 설계 및 검증 시스템'을 목표로 구축된 플랫폼이다.
남기엽 사장은 "AI로 신약을 설계한다고 말하는 회사는 많지만, 실제로 그 설계물이 GLP 독성시험과 임상 1상에서 예측대로 작동한 사례는 극히 드물다"며 "우리는 PHI-101을 통해 그 실증을 보여줬다"고 강조했다.
케미버스는 크게 두 가지 모듈로 구성된다. 하나는 제너레이티브 모델 기반 후보물질 생성기인 '켐젠(ChemGEN)', 다른 하나는 약물 타겟 및 신규 적응증 예측을 수행하는 '딥리콤(DeepRECOM)'이다. 켐젠은 자체적으로 합성한 구조-활성 상관관계(SAR, structure activity relationship) 분석이 가능한 100개의 화합물들로 학습해 새로운 생성된 물질들을 설계하고, 생성모델에 의해 설계된 상위 30개 화합물을 선별한 뒤 약물설계 효과를 검증했다.
이때 상위 30개 중 30개 전부가 실제 활성(truth positive)을 갖는 화합물들로 생성될때까지의 조건을 확인했고, 1종의 화합물을 합성하여 표적단백질의 활성과 암세포주에서 활성이 증가함을 확인했다. 이는 국내외 AI 플랫폼을 통틀어도 보기 드문 성과라는 평가다.
그는 "신약개발에서 가장 큰 낭비는 false positive를 실제로 합성하고 검증하다가 자원을 소모하는 것이다. 우리는 AI가 내놓은 물질이 실제로 약효를 가질 확률을 극단적으로 높이기 위한 인공지능 약물설계 방법을 개발했다"고 설명했다.
이 과정에서 파로스는 자체 알고리즘만 고집하지 않았다. 엔비디아의 AI 신약 설계 플랫폼 ‘바이오니모(BioNeMo)’를 활용했다. 초기 조건에서 BioNeMo를 활용해 생성한 상위 30개 화합물 중 약 7~8개에서만 적합했지만, 약물설계 효과를 높은 생성모델 설계 조건을 확립했다. 그는 "이 결과를 바탕으로 외부 알고리즘의 장단점을 분석해 약물서례 생성모델 방법을 지속적으로 개선하고 있다"고 말했다.
플랫폼의 강점은 약물 생성뿐 아니라 독성 예측의 정확도에서도 입증됐다. 케미버스는 심장 독성 관련 주요 약물성 지표들을 사전 예측할 수 있으며, PHI-101의 경우 딥러닝 기반 시뮬레이션에서 심장 독성이 나타나지 않을 것으로 예측된 물질이었다. 이후 진행된 비글견을 이용한 GLP 독성시험 및 임상 1상에서도 경쟁 약물인 퀴자티닙, 길터리티닙과 달리 Grade 3 이상의 심장 부작용이 단 한 건도 관찰되지 않았다.
"PHI-101 개발 당시 우리는 이미 7년 전부터 딥러닝 기반 심장 독성 예측 모델을 구축하고 있었고, 이 모델이 제안한 물질이 실제로 안전하다는 것을 전임상, 임상 단계에서 모두 확인했다. 설계-예측-실증으로 이어지는 AI 기반 개발의 완전한 사례를 갖고 있는 셈"이라고 그는 말했다.
향후 전략에 대해 그는 "케미버스는 희귀·난치성 질환에 초점을 맞춰 개발 중이며, 빠른 물질 설계-예측-실증 사이클을 통해 개발 속도와 정확도를 함께 확보할 수 있다"며 "차세대 기술인 양자컴퓨팅 기반 분자동역학 알고리즘도 검토 중으로, 플랫폼 고도화에 지속적으로 투자하고 있다"고 밝혔다.
"101 다음은 501...더 정교한 개발로 기술이전 추진할 것"
PHI-101에 이어 파로스아이바카라사이트 비타임가 주력하는 파이프라인은 PHI-501이다. 두 임상 진행중 약물은 각기 다른 작용 기전과 적응증을 기반으로, 글로벌 기술이전 또는 조건부 승인 이후 상용화를 겨냥하고 있다.
남기엽 사장은 "PHI-501은 pan-RAF 및 DDR1 이중 저해제로, 흑색종과 대장암을 포함한 고형암을 적응증으로 하고 있다"며 "기존 BRAF 저해제 치료를 받고도 재발한 환자에게 새로운 치료 옵션이 될 수 있을 것으로 기대한다"고 밝혔다. 그는 이어 "특히 BRAF 저해제는 이미 글로벌에서 상용화된 지 10~15년이 지난 약물이다. 이에 따라 내성 환자군이 꾸준히 누적되고 있고, PHI-501은 바로 그 공백을 메울 수 있는 차세대 옵션으로 포지셔닝될 수 있다"고 설명했다.
PHI-501은 지난 6월 국내에서 임상 1상 시험 승인을 받아 임상 진입을 위한 준비 절차를 마쳤으며, 초기 확장 코호트를 운영해 안전성과 효능 신호를 동시에 확보한다는 전략이다. 남 사장은 "효능이 확인되면 글로벌 제약사들의 관심이 빠르게 이어질 가능성이 있다. 실제 유사 기전 후보물질이 과거 기술이전된 사례를 보면, 초기 임상 데이터 확보 직후 계약 논의가 시작된 바 있다"고 말했다.
또 다른 후속 파이프라인인 PHI-301은 파로스의 AI 플랫폼 켐젠(ChemGEN)을 통해 설계된 항암 후보물질이다. "PHI-301은 우리가 AI를 통해 실제로 설계한 구조 기반 항암물질로, 내부 실험을 통해 활성을 확인한 상태다. 현재 동물시험 단계에서 유효성 평가 단계에 있으며, 케미버스 기반 설계-검증-임상 진입까지의 구조를 PH-101과 동일하게 반복하고 있다"고 설명했다.
그는 이어 "AI 플랫폼으로 단순히 분자만 만드는 게 아니라, 임상까지 간다는 것을 PHI-101으로 증명한 만큼, 후속 파이프라인들도 같은 방식으로 개발 효율성과 성공률을 높이는 구조를 확립하고 있다"고 덧붙였다.
파로스는 이외에도 신규 혈액암 표적저해제 총 5개 파이프라인을 보유하고 있으며, 각 후보물질은 타깃 적응증과 기술 성숙도에 따라 글로벌 기술이전, 공동개발, 국내 병행 사업화 등 복수의 상업화 경로를 염두에 두고 개발이 진행되고 있다.
그는 "AI 플랫폼을 연구실에 머무르게 하지 않았다. 실제 임상에서 작동하는 플랫폼을 만들었고, PHI-101은 그 실증의 첫 결과"라며 "글로벌 제약사와의 협업, 조건부 승인 전략, AI 기반 설계 및 독성 예측까지 모두 준비된 상태에서, 환자에게 도달할 수 있는 약을 만드는 데 집중하겠다"고 말했다.
