한독 FGFR2 융합/재배열 담관암 표적치료제 '페마자이레' 29일 허가
노보노디스크 주1회 비만 치료제 위고비 27일 허가
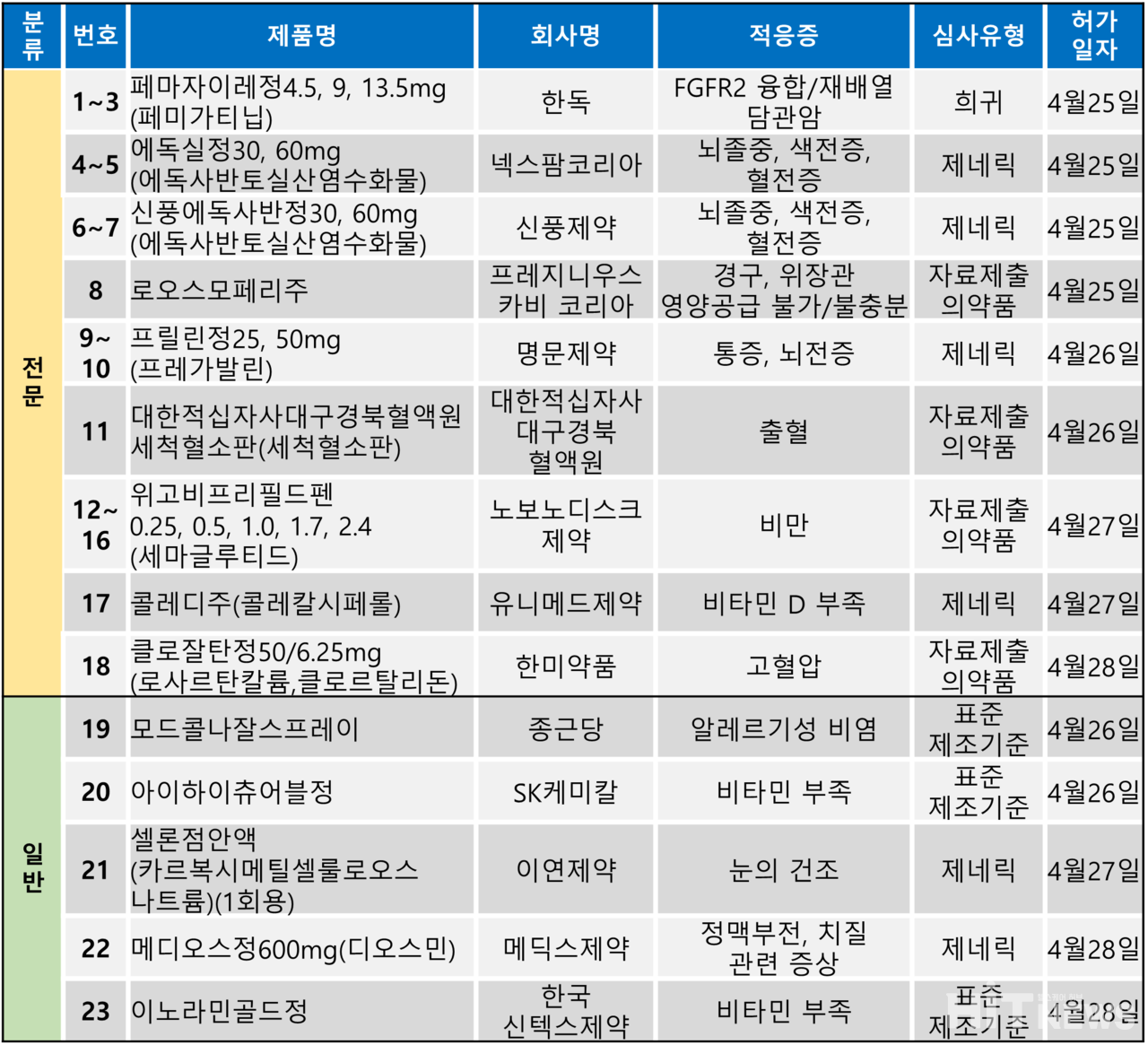
지난주(4월 24~28일) 총 23개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 18개 품목, 일반의약품은 5개 품목이었다.
허가 품목들은 FGFR 2 융합 또는 재배열 담관암, 뇌졸중, 뇌전증, 출혈, 비만, 고혈압 등 다양한 적응증으로 허가됐다.
한독이 개발한 FGFR 2(섬유아세포 성장인자 수용체 2) 표적치료제 '페마자이레정(성분 페미가티닙)'이 지난 25일 품목허가됐다.
식약처는 페마자이레정 △4.5㎎ △9㎎ △13.5㎎ 등 3개 용량에 대해 '1회 이상의 전신 치료를 받은 성인에서 섬유아세포 성장인자 수용체2(FGFR2) 융합 또는 재배열이 존재하는 국소 진행성 또는 전이성 담관암'을 대상으로 허가했다.
이 약은 세포의 성장과 분화에 관여하는 FGFR2 융합이나 재배열로 인해 발생한 암세포의 증식을 억제하는 경구용 FGFR 억제제다. FGFR은 세포막 수용체로 세포 성장 및 생존과 분화를 조절하는데, 돌연변이가 생기면 다양한 암을 유발한다.
회사는 2021년 11월 식약처로부터 페마자이레를 '희귀의약품'으로 지정받았다. 이후 같은 해 12월 신속심사 대상으로 지정받으며, 최근까지 허가·심사를 받아왔다.
한편 한독은 작년 4월 나스닥 상장사 인사이트(Incyte)로부터 페마자이레의 국내 판권 계약을 체결한 바 있다. 계약 내용에 따르면, 한독은 페마자이레 국내 허가 승인 후 이를 출시하고 독점 배포하는 유통 권한을 가진다.
노보노디스크제약의 GLP-1(Glucagon-Like Peptide 1) 유사체 비만 주사제 '위고비프리필드펜(성분 세마글루티드)'가 지난 27일 품목허가됐다.
이번에 허가된 품목은 △위고비프리필드펜0.25 △위고비프리필드펜0.5 △위고비프리필드펜1.0 △위고비프리필드펜1.7 △위고비프리필드펜2.4 등 5개 용량이다.
허가 적응증은 '성인 환자의 체중 감량 및 체중 유지를 포함한 체중 관리를 위해 칼로리 저감 식이요법 및 신체 활동 증대의 보조'다.
이 약은 체내 호르몬인 GLP-1은 인슐린 분비를 증가시키고, 식욕을 감소시킨다. 이와 유사한 GLP-1 유사체는 장기 지속형으로 제작돼 체내에서 더 오래 효과를 유지시킨다.
회사가 보유하고 있는 또 다른 GLP-1 유사체 '삭센다(성분 리라글루티드)'와 다른 점은 투약 주기다. 기존 24시간마다 투약해야했던 삭센다와 달리, 위고비는 주1회만 투여하면 된다.
초기 용량은 주 1회 0.25mg로, 4주차까지 이를 유지한 뒤, 5~8주차 0.5mg, 9~12주차 1mg, 13~16주차 1.7mg 등 위장관 증상의 발생 가능성을 감소시키기 위해 단계적으로 용량을 증량해야 한다. 최종 유지 용량은 2.4mg이다.
현재 삭센다는 국내 비만약 시장에서 부동의 1위를 차지하고 있다. 위고비의 등장으로 비만약 시장의 판도가 어떻게 바뀔지 주목된다.
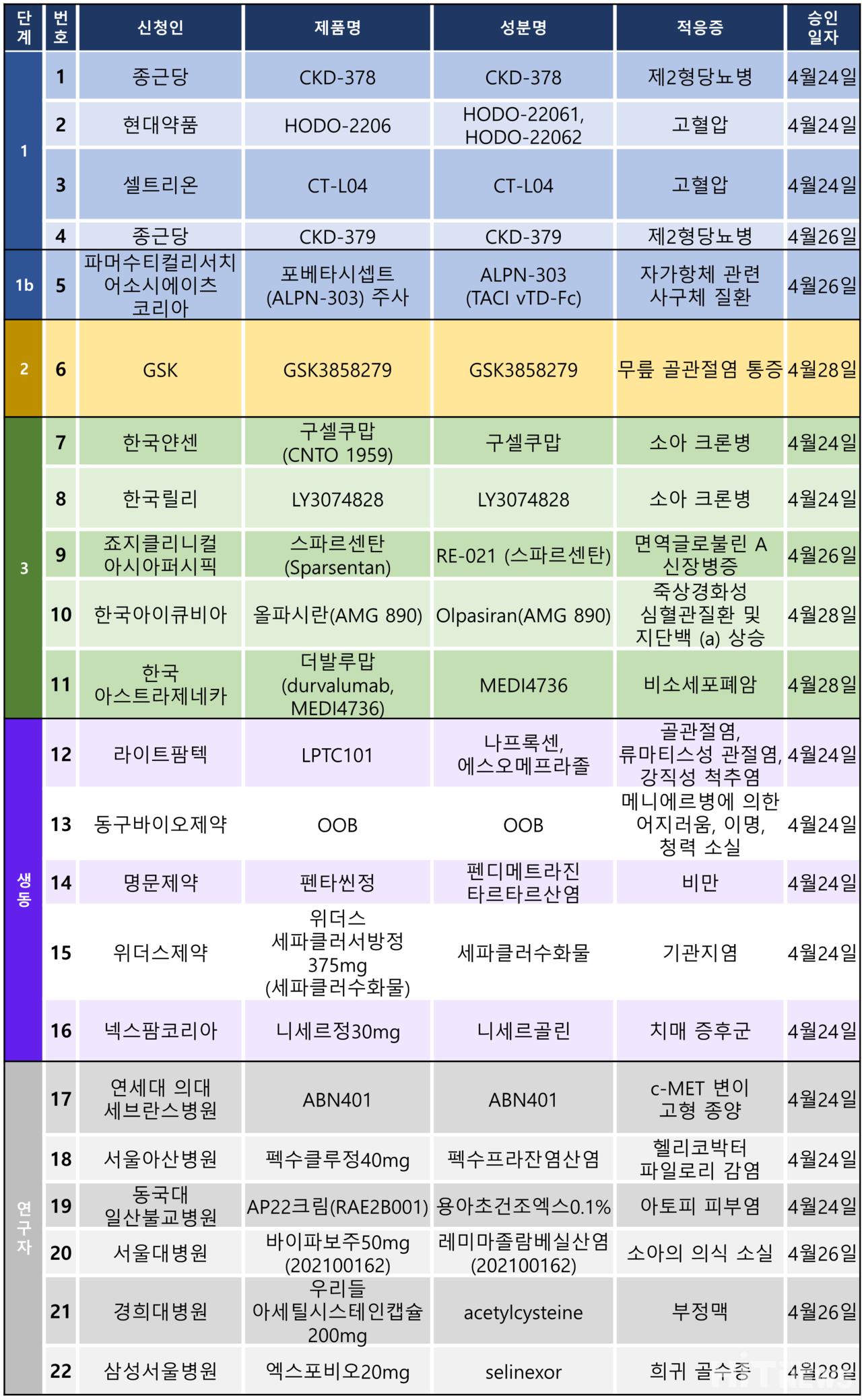
임상시험계획은 총 22건이 승인됐다. 세부적으로 △1상 4건 △1b 1건 △2상 1건 △3상 5건 △생물학적동등성 5건 △연구자임상 5건 등이다.
이 임상 시험들은 고혈압, 제2형당뇨병, 자가항체 관련 사구체 질환, 무릎 골관절염 통증, 크론병, 비소세포폐암 등 다양한 질환을 대상으로 승인됐다.
암젠이 개발 중인 죽상경화성 심혈관질환(ASCVD) RNAi(RNA 간섭) 치료제 '올파시란(AMG 890)'의 임상3상 시험계획이 지난 28일 식약처로부터 승인됐다.
죽상경화증은 지방물질의 침전물 조각(죽종 또는 죽상 경화성판)이 중간 크기 또는 큰 동맥의 벽에 생겨서 혈액의 흐름을 감소시키거나 막는 상태를 말한다. 죽상경화증은 뇌, 심장, 신장 등의 동맥에 영향을 미칠 수 있는 데, 이로 인해 ASCVD가 발생할 수 있다. 학계에서는 지단백 (a)를 ASCVD의 원인 중 하나로 주목하고 있으며, 올파시란은 간에서 지단백 (a) 합성을 감소시키는 siRNA(소형간섭 RNA)로 작용한다.
이번 임상3상은 죽상경화성 심혈관질환 및 지단백 (a) 상승이 있는 환자에서 주요 심혈관 사건에 대한 올파시란의 영향을 평가하는 이중 눈가림, 무작위 배정, 위약 대조, 다기관 임상시험이다.
임상은 △서울아산병원 △전남대학교병원 △삼성서울병원 △분당서울대병원 △경희대병원 △가톨릭대 서울성모병원 △서울대병원 △연세대 원주세브란스기독병원 △강북삼성병원 △고려대 의대 부속 구로병원 △길 병원 △연세대 의대 세브란스병원 △고려대 의대 부속병원 △동아대병원 등 14개 의료기관에서 진행된다.
한편 암젠은 작년 11월 미국심장협회 연례학술대회(AHA 2022)에서 올파시란의 임상2상(OCEAN(a)-DOSE) 결과를 발표한 바 있다.
당시 회사는 환자 281명을 대상으로 임상을 진행한 결과, 36주차에서의 기준선 대비 지단백 (a) 변화 정도를 소개했다. 환자들은 올파시란 10mg, 75mg, 225mg 등을 12주 간격으로 피하주사, 225mg을 24주 간격으로 투약한 군 및 위약군으로 무작위 배정됐다.
36주차에서 각 지단백 (a) 변화율은 올파시란 용량 의존적인 것으로 나타났으며, 위약군은 평균 3.6% 증가한 것으로 확인됐다. 위약군의 지단백 (a) 변화를 반영한 변화폭을 살펴보면 10mg 투여군이 70.5%, 75mg 투여군 97.4%, 225mg 투여군(12주 간격) 101.1%, 225mg 투여군(24주 간격) 100.5% 감소한 것으로 나타났다.
